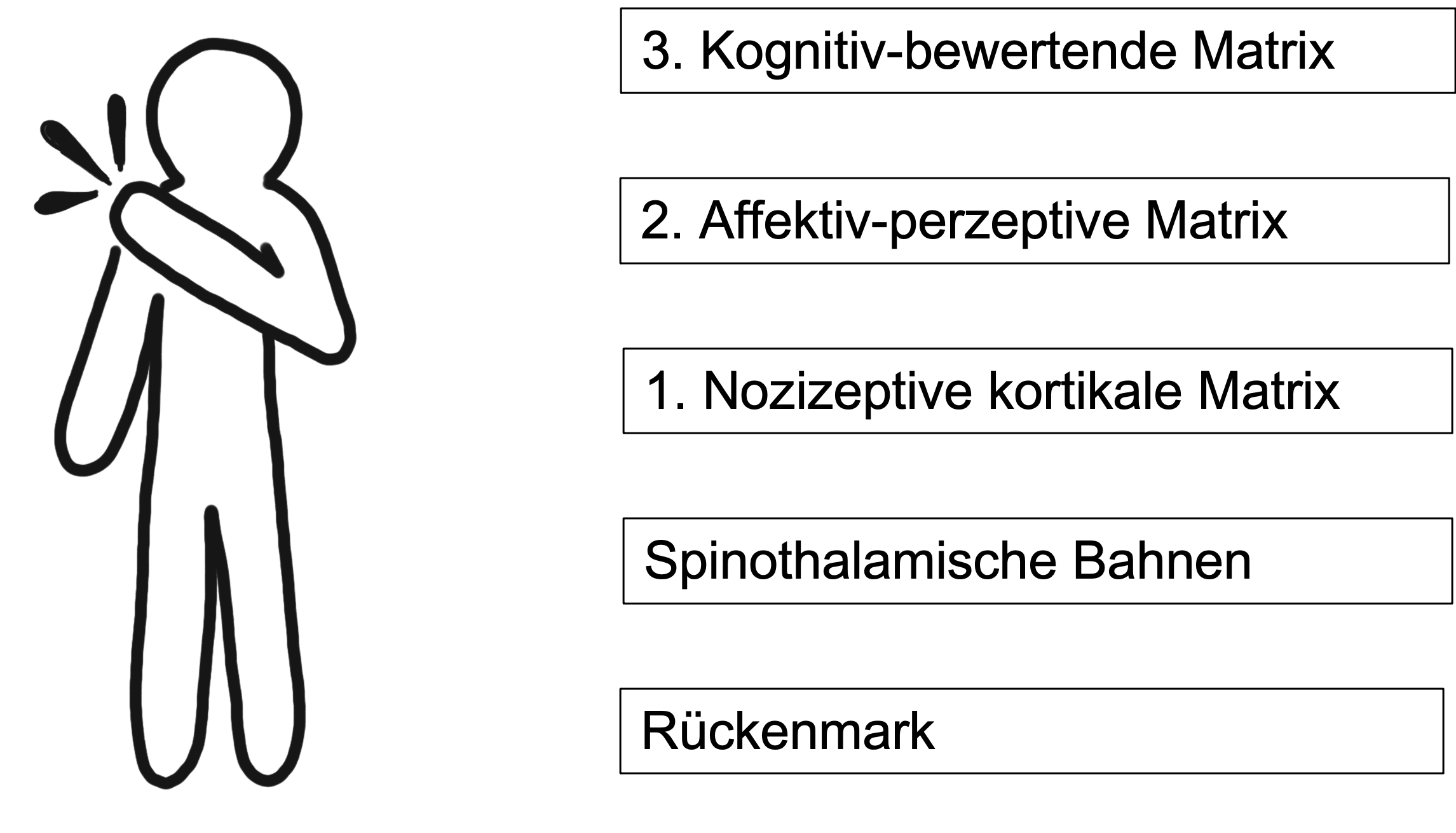Behandlung chronischer neuropathischer Schmerzen mit rTMS und tDCS
Von chronischen Schmerzen spricht man, wenn sie während mindestens 3 Monaten bestehen. Meist entwickeln sie sich aus einem akuten Schmerz mit einer klaren körperlichen Ursache wie Migräne, Nervenschädigung (z.B: Bandscheibenvorfall), Knochen, Gelenks- und Sehnenverletzungen oder auch Schädigungen innerer Organe. Bleibt der körperliche Schmerzreiz länger bestehen, so sinkt die Schmerzschwelle und der Schmerz wird schneller und stärker wahrgenommen. Das kann dazu führen, dass noch Schmerzen wahrgenommen werden, wenn bereits kein körperlicher Reiz mehr besteht, die Verletzung schon abgeheilt ist. Häufig wird dann vom Schmerzgedächtnis gesprochen.
Bei vorbestehenden psychischen Störungen wie Angst und Depression kann das Schmerzempfinden von Anfang an verstärkt sein. Zudem führen physische Schmerzen ihrerseits zu depressiven Symptomen, woraus sich ein somato-psycho-somatischer Teufelskreis ergeben kann.
Die Behandlung einmal chronifizierter Schmerzen ist häufig schwierig. Die wichtigsten Behandlungsmethoden sind Medikamente und Physiotherapie. Die Langzeitbehandlung mit Medikamenten führt dabei nicht selten zu neuen Problemen wie Nierenschädigung bei nicht-steroidalen Rheumatika oder Abhängigkeit bei Opioiden. Um dem somato-psycho-somatischen Teufelskreis entgegenzuwirken, kommen psychotherapeutische Methoden zum Einsatz.
Je nach Schmerzsyndrom können auch neurochirurgische Eingriffe zum Einsatz kommen: Unterbrechung von Schmerzbahnen oder Implantation von Stimulationssystemen, die die Schmerzweiterleitung und auch die Schmerzwahrnehmung abschwächen sollen. Neben den invasiven chirurgischen Methoden kommen auch nicht-invasive Stimulationsverfahren zum Einsatz: die repetitive transkranielle Magnetstimulation (rTMS) und die transkranielle Gleichstromstimulation (tDCS). Mit beiden werden Hirnrindenareale stimuliert.
Wie aber kann es sein, dass die Stimulation von Hirnrindenarealen neuropathische Schmerzen z.B. im Bein lindern? Um das zu verstehen, bewährt sich das Konzept der Schmerzmatrix bzw. der Schmerzmatrizen (1).
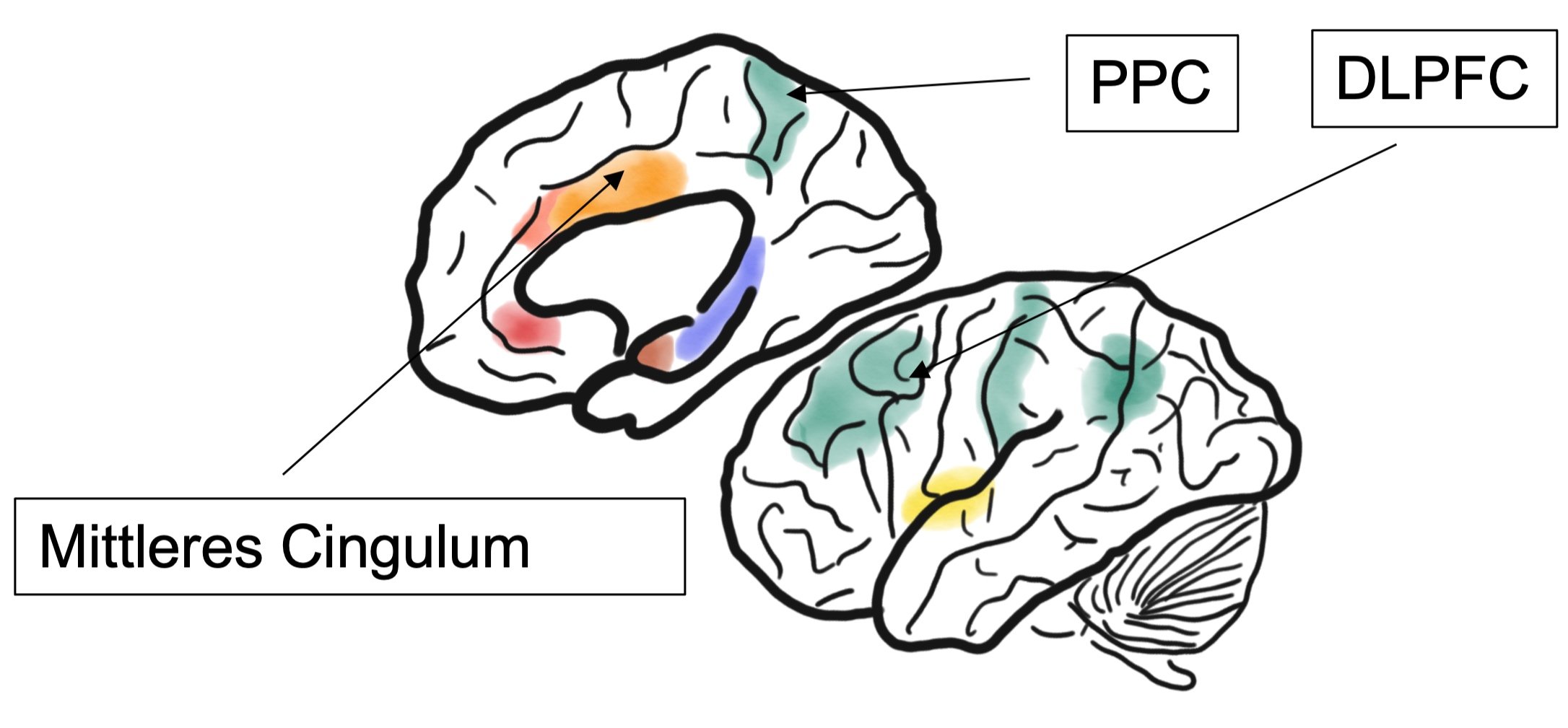
Für das Verständnis sind allerdings einige neuroanatomische Kenntnisse notwendig. Im ersten Bild sieht man rechts den sensorischen und den motorischen Kortex. In Ersterem kommen die Sinneseindrücke in der Hirnrinde an, von letzterem gehen die Signale aus, wenn Muskeln aktiviert werden. Bevor die Sinneseindrücke aus den aufsteigenden Bahnen den Kortex erreichen, werden sie im Thalamus gefiltert und nur die für aktuell als wichtig empfundenen weitergeleitet. Die Insel ist mit schwacher Farbe angedeutet, weil sie von den Hirnrindenarealen verdeckt wird. Sie spielt eine grosse Rolle bei der Wahrnehmung innerer Reize (z.B. Hunger) und auch von Schmerzen.
Die aufsteigenden Bahnen leiten auch Informationen zur Amygdala, welche eine wichtige Rolle bei der emotionalen Bewertung von Situationen und der Analyse möglicher Gefahren spielt. Das vordere Cingulum ist wesentlich beteiligt an Funktionen wie der Aufmerksamkeit, der Fehler-Detektion und der Modulation emotionaler Reaktionen.
Der Präfrontalkortex ist für die Handlungsplanung und die Emotionsregulation zuständig. Über die absteigenden Bahnen werden nicht nur die Muskeln für die Antwort auf einen Reiz gesteuert, sondern auch das zentrale Höhlengrau im Mittelhirn (Tegmentum), welches wichtig für die absteigenden opioidergen schmerzhemmenden Bahnen ist.
Die Schmerzmatrix umfasst nun ein Netzwerk von Rindenfeldern, die dem Erleben von Schmerz zugrunde liegen. Es ist ein System zum Schutz der körperlichen Integrität durch Entdeckung und Bewertung bedeutsamer sensorischer Reize. Unterschieden werde verschiedene Ebenen: die nozizeptive kortikale Matrix, die affektiv-perzeptive und die kognitiv-bewertende Matrix.
In der ersten, der nozizeptiven kortikalen Matrix wir der Schmerz wahrgenommen und lokalisiert. Die posteriore Insel und Teile des posterioren Operculums reagieren als erste auf Schmerzreize. Sie werden auch bei Schmerzreizen im Schlaf und im Koma aktiviert. Ihre Reizung führt zudem zu Schmerzen.
Für die bewusste Wahrnehmung sind jedoch noch weitere Matrizen notwendig. Zunächst die zweite, die affektiv-perzeptive kortikale Matrix für das emotionale Erleben und den Vergleich mit schmerzhaften Vorerfahungen: die vordere Insel, das vordere Cingulum, Amygdala und Hippokampus. Diese erhalten keine direkten Informationen über Schmerzen. Deren Stimulation führt nicht zu Schmerz und deren Destruktion führt nicht zu Analgesie. Die Aktivierung der vorderen Insel führt jedoch zu vegetativen Reaktionen und diese im Sinne eines Teufelskreises wieder zu (unangenehmen) körperlichen Symptomen.
Für das bewusste Bewerten schliesslich spielt die dritte, die kognitiv bewertende kortikale Matrix mit mittlerem Cingulum, dem dorsolatealen Pröforntalkortex und dem posterioren Parietalkortex die wichtigste Rolle.
Andauernde Schmerzreize führen auf verschiedenen Wegen zu chronischen Schmerzen. Bei den aufsteigenden, den Schmerz vermittelnden Bahnen kommt es zu folgenden Veränderungen:
Leichtere Erregbarkeit der Rezeptoren und der peripheren Nerven
Leichtere Erregbarkeit Ganglien im Hinterhorn (Glutamat —> NMDA-Rezeptoren-Aktivierung —> LTP)
die Rezeptoren auf Rückenmarksebene ist die Aktivität/Funktion von GABA-Interneurone vermindert
Bei den absteigenden, den Schmerz modulierenden Bahnen kann es auch zu Veränderungen kommen:
Verstärkung von Ruminieren über Schmerz und Zukunft
Hemmung der (serotonerg und noradrenerg) deszendierenden Bahnen vom zentralen Höhlengrau
Die Wahrnehmung und die Chronifizierung von Schmerz ist somit ein aktiver Prozess, sich ständig neu rekonstruierend durch Integration von eingehenden Signalen, Erinnerungen und internen Repräsentationen.
Das Konzept der Schmerzmatrix kann die Dissoziation zwischen Schmerzreiz und Schmerzwahrnehmung gut erklären. Bleiben die Matrizen auch nach Abheilen des Gewebeschadens aktiviert, so werden weiterhin Schmerzen erlebt.
Die die kognitiv-bewertende Matrix kann die affektiv-perzeptive Matrix je nach Kontext und Vorerfahrungen modulieren. Die Aufmerksamkeit zum Schmerz verstärkt die Aktivität der nozizeptiven Matrix – die Ablenkung unterdrückt sie hingegen.
Psychotherapeutische Verfahren wie z.B. auch die Hypnose machen sich dies zunutze.
1991 konnten Tsubokawa et al. (2) zeigen, dass die elektrische Stimulation des motorischen Kortex mit implantierten Elektroden zentrale, durch eine Verletzung des Thalamus verursachte Schmerzen lindert. Die Stimulation des Motorkortex führt also zu einer Abschwächung der Aktivität der affektiv-perzeptiven und der kognitiv-bewertenden Matrix.
1998 gelang es dann Lefaucheur et al. (3) nachzuweisen, dass chronische Schmerzen auch durch die nicht-invasive Stimulation des Motorkortex mit Hilfe der repetitiven Transkraniellen Magnetstimulation (rTMS) gelindert werden können.
Aktuell geht man davon aus, dass die Stimulation des Motorkortex auf zwei Wegen analgetisch wirkt. Einerseits werden die deszendierenden (absteigenden) schmerzhemmenden Bahnen stimuliert. Andererseits werden Strukturen der affektiv-perzeptiven und der kognitiv-wertenden Matrix in ihrer Aktivität abgeschwächt.
Neben der repetitiven Transkraniellen Magnetstimulation (rTMS) können neuropatische Schmerzen auch mit der transkraniellen Gleichstromstimulation (tDCS) behandelt werden. Beide Methoden zeigen eine gute Evidenz: Evidenz Level A für dir rTMS; Lebel B für die tDCS (4,5).
Literatur
1. Garcia-Larrea L, Peyron R. Pain matrices and neuropathic pain matrices: A review. Pain. Dezember 2013;154(Supplement 1):S29–43.
2. Tsubokawa T, Katayama Y, Yamamoto T, Hirayama T, Koyama S. Treatment of thalamic pain by chronic motor cortex stimulation. Pacing Clin Electrophysiol PACE. Januar 1991;14(1):131–4.
3. Lefaucheur J-P. Pain. Handb Clin Neurol. 2013;116:423–40.
4. Lefaucheur J-P, Aleman A, Baeken C, Benninger DH, Brunelin J, Di Lazzaro V, u. a. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS): An update (2014–2018). Clin Neurophysiol. Februar 2020;131(2):474–528.
5. Lefaucheur J-P, Antal A, Ayache SS, Benninger DH, Brunelin J, Cogiamanian F, u. a. Evidence-based guidelines on the therapeutic use of transcranial direct current stimulation (tDCS). Clin Neurophysiol. Januar 2017;128(1):56–92.